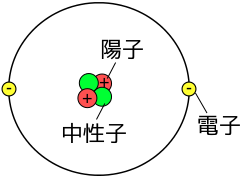
原子の基本構造 原子は原子核と電子からなり、電子が原子核の周囲を回っています。 そして原子核は陽子と中性子という粒子が固まった状態です。 大切なのは陽子がプラス、電子がマイナスの電荷を持っているということです。 現在の物理でもなぜかは分かっていませんが、私達の住む宇宙はプラスに帯電したモノとマイナス
- …続きを読む
- [speech_bubble type="ln-flat" subtype="L1" icon="seitom3.gif" name="小山くん"]原子の構造ってよく分からないな[/speech_bubble]
[speech_bubble type="ln-flat" subtype="R1" icon="seitow4.gif" name="山田さん"]K殻には電子が2個、L殻には8個入るとかって覚えるしかないのかな?[/speech_bubble]
[speech_bubble type="ln-flat" subtype="L1" icon="seitom3.gif" name="小山くん"]元素と原子って何が違うんだろう[/speech_bubble]
原子の基本構造
原子は原子核と電子からなり、電子が原子核の周囲を回っています。
そして原子核は陽子と中性子という粒子が固まった状態です。
大切なのは陽子がプラス、電子がマイナスの電荷を持っているということです。
現在の物理でもなぜかは分かっていませんが、私達の住む宇宙はプラスに帯電したモノとマイナスに帯電したモノの間には引き合うように力が働くように出来ています。
中性子は電荷を持っていないので、原子核は陽子の数と比例してプラスの電荷を持っていることになります。
これにマイナスの電荷を持つ電子が引き寄せられるので、原子核の周りを電子が回った状態になります。(電子と原子核が引き合っているなら、電子が原子核に衝突するんじゃないかと疑問に思うかもしれませんが、「引き合っている物体が回転運動をする」というのは太陽と地球が引力で引き合っているのにぶつからないことを考えると納得できると思います)
また電子と中性子のもつ電荷は大体等しいので、電子と陽子が同じ数ずつあれば、原子全体では電気的にちょうど0になります。
通常、原子はこの状態で安定します。もし陽子より電子が少なかったら、原子全体がプラスの電荷をもつ状態なので、他のところにある電子を引き寄せてしまうと考えれば、これも自然なことだと思います。電子殻
原子核の周りを電子が回っているのは理解できたと思いますが、じつは電子が飛ぶ軌道はいくつか決まった層を作ります。
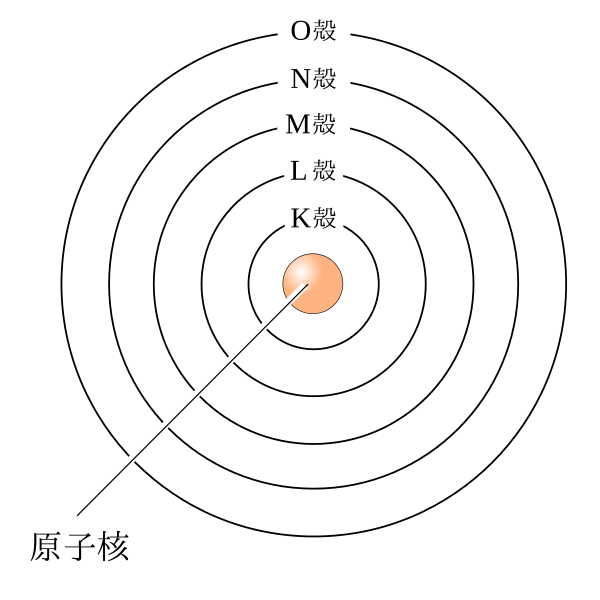
一番内側の電子殻をK殻とよび、アルファベット順にL殻、M殻……と名前がつきます。
これは昔の人がK殻の電子殻を発見した時、「もしかしたらこの内側にも電子殻もあるかもしれない」ということで、将来J殻やI殻が見つかってもいいようにKのアルファベットを割り当てたことに由来しますが、結局K殻より内側の電子殻は見つかりませんでした。それぞれの電子殻にはK殻に2個、L殻に8個、M殻に18個の電子が入ります。
どの原子核にいくつの電子が入るかは知っていないといけませんが、実は一見不規則にみえる2,8,18という数列には規則性があります。
奇数を並べると1,3,5となりますね。これを二倍すると、2,6、10となります。
これを順番に足していくと、内側から数えて何番目の電子殻にいくつの電子が入るか求めることが出来ます。例えば内側から2番めのL殻は二個分足して2+6個、内側から3番めの電子殻であるM殻は三個分で2+6+10個になります。
同じようにして、4番目のN殻には2+6+10+12個の電子がはいることができます。なぜこうなるかは高校範囲を越えて、原子雲について考える必要があります。
元素と原子
原子というのは簡単に言ってしまえば、「物質を細かく見ていったとき、最後に出てくる陽子、中性子、電子からなる最小単位」です。
一方で元素は「原子を陽子の数で分類したときの種類」を指します。
陽子が1個の原子を水素という元素と、陽子が6個の原子を炭素という元素というカテゴリにいれると考えると分かりやすいと思います。実は昔は「水素=陽子と電子が1つずつ」というように、ひとつの元素というカテゴリに分類できる原子が1つしかなかったので、あまり元素と原子を区別する必要はありませんでした。
しかし現在では「陽子が6個、電子が6個、中性子が6個の炭素」と「陽子が6個、電子が6個、中性子が7個の炭素」のように陽子の数が同じでも中性子の数が違う原子がみつかります。
同じ陽子数なのに他の条件が違う原子のことを同位体と呼びます。